Datamatrix farmaci: tecnologie per la serializzazione dei medicinali

Datamatrix farmaci: è questa la tecnologia di riferimento quando si parla di prevenzione della contraffazione in ambito farmaceutico. Con l’entrata in vigore della direttiva 2011/62/Ue sulla prevenzione delle attività di contraffazione dei medicinali, tutti i paesi dell’Unione Europea sono obbligati a recepire e convertire in legge la direttiva. All’Italia (e alla Grecia) è stata concessa una deroga di sei anni per recepire la norma ma, essendo il primo produttore in Europa di farmaci, le aziende produttrici che vogliono esportare negli altri paesi dell’Unione, devono necessariamente adeguarsi alle condizioni previste dalla direttiva.
Più nello specifico, quali sono queste condizioni? Si parla in primis di serializzazione del farmaco: le confezioni devono essere dotate delle cosiddette “safety feature”: un identificativo univoco e di un dispositivo antimanomissione (Atd, anti-tampering device). Questo deve contenere quattro dati: codice prodotto, numero seriale, numero del lotto, data di scadenza) ed è inserito all’interno di un barcode visibile sulla confezione. In più, dev’essere implementato un sistema di antimanomissione in modo da garantire l’integrità della confezione che, una volta aperta, non possa essere richiusa correttamente.
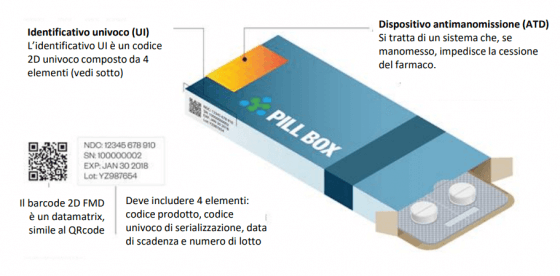
Come vengono gestiti i dati all’interno di questo scenario? I titolari AIC devono caricare gli UI sull’EMVS (Hub europeo, European Medicines Verification System) che invia i dati ai sistemi nazionali degli Stati membri in cui i farmaci sono commercializzati. I soggetti che dispensano i medicinali verificano l’autenticità della confezione al momento della vendita disattivando l’identificativo univoco (decommissioning). La responsabilità dell’invio del dato all’Hub Europeo è dell’On-boarding Partner (OBP), ovvero del titolare AIC. Per le aziende in conto terzi l’invio dei dati può essere effettuato in 2 modi:
- Inviare il dato al titolare AIC che lo carica sull’Hub;
- Utilizzare un gateway provider intermedio per l’invio del dato all’Hub.
L’azienda conto terzi deve dotarsi di tutte le tecnologie, macchinari e aree dedicate ai processi di serializzazione secondo i requisiti GMP.
Datamatrix pharma: come funzionano e come utilizzarli nel settore farmaceutico
Quando si parla di matrici, si intende nello specifico un datamatrix posizionato sui farmaci: questo di distingue dal classico QRCode per una serie di caratteristiche.
Sono entrambi esempi di matrici bidimensionali o codici 2D, composti da una serie di moduli neri in uno schema ordinato di forma regolare, ma i datamatrix:
- sono più piccoli e si adattano perfettamente a confezioni ed etichette di dimensioni ridotte;
- sono caratterizzati da un formato di codifica più sicuro ed efficiente, considerando che presenta una maggiore resistenza al deterioramento dell’etichetta e quindi non si generano errori di lettura;
- Riescono ad immagazzinare una grande quantità di informazioni.
Omnia Group ha lavorato con le matrici 2d, di tipo QRCode, per un importante gestore telefonico italiano. In particolare, Omnia si è occupata di due progetti: la creazione di un sistema di erogazione qualificata ed autorizzazione alla stampa in proprio tramite QRcode e lo sviluppo di una soluzione per l’autorizzazione all’attivazione di carte eSim virtuali tramite QRcode.
Tornando alla necessità di recepimento della direttiva europea, in Italia, al momento, l’attuale sistema di tracciatura non rispecchia le condizioni poste dalla direttiva 2011/62/Ue, basandosi non sul datamatrix ma su un sistema di bollini ottici posti sulle confezioni. Questo strumento presenta diverse problematiche, ribadite ripetutamente dalle aziende: difetti di qualità nei materiali utilizzati, scarsa trasparenza nelle procedure di evasione degli ordini, interruzione delle forniture, trasferimento degli ordini in corso d’opera. Questa serie di inefficienze comporta un pesante ritardo nella produzione dei bollini ottici e, di conseguenza, dei farmaci.
In ottemperanza della direttiva, anche i produttori italiani devono necessariamente passare al datamatrix. Questo comporterà una serie di vantaggi tangibili fin da subito: il datamatrix viene stampato direttamente sulle confezioni e non prestampato e successivamente apposto come il bollino. Questo comporta la riduzione dei tempi di serializzazione, una riduzione dei costi legati a questo procedimento e maggiore rapidità nella consegna dei medicinali alle aziende di distribuzione.
L’unione della serializzazione dei medicinali tramite datamatrix richiesta dalla normativa europea per contrastare la contraffazione rappresenta una chiave di svolta per assicurare la massima qualità e trasparenza nella fornitura di farmaci e dev’essere vista, in generale, come un’opportunità di miglioramento nella gestione dell’industria farmaceutica.
Oltre a supportare le aziende al recepimento della direttiva dal punto di vista tecnologico, Omnia Group offre anche un servizio innovativo per le aziende che si occupano della fase di distribuzione: la soluzione sviluppata è software in grado di misurare lo stato di conservazione della merce durante il trasporto e, in particolare, misura il rispetto di soglie preimpostate riguardanti la temperatura, l’umidità e le vibrazioni. Questa soluzione si basa su tag Rfid e su una dashboard di monitoraggio cloud native che raccoglie e condivide i dati a tutti gli attori della catena.
Ti potrebbe interessare anche
Come l’AI rende le recensioni uno strumento...
3.06.2025
Integrare AI e blockchain nella gestione delle recensioni significa migliorare l’esperienza utente, offrendo contenuti rilevanti; aumentare la reputazione online, grazie a una maggiore trasparenza; stimolare le vendite, offrendo ai clienti una base solida per decidere con fiducia.
Leggi l'articoloIntegrazione sistemi informativi: scelta tecnica...
26.05.2025
Nel panorama IT odierno, sempre più frammentato e dinamico, l’integrazione di sistemi informativi non è più un’opzione, ma una necessità strategica. Le imprese si trovano a gestire ambienti eterogenei: sistemi legacy, servizi cloud, applicazioni SaaS e dispositivi IoT che devono comunicare tra loro in tempo reale. L’infrastruttura di integrazione diventa quindi...
Leggi l'articoloGarantire recensioni affidabili grazie...
14.05.2025
Le recensioni online sono fondamentali per guidare le decisioni d’acquisto. SmartCare Review mostra come la combinazione di Blockchain e AI permette di ottenere recensioni affidabili e significative per l'utente.
Leggi l'articoloDa Cobol a Java con l’ausilio della GenAI
7.05.2025
La trasformazione delle applicazioni legacy, specialmente quelle basate su tecnologie mainframe come il Cobol o il PL/I, rappresenta una delle sfide più complesse nel panorama IT attuale. Questi ambienti, ancora vitali per molte infrastrutture strategiche, richiedono...
Leggi l'articoloAzure API Management: la gestione strategica...
10.10.2024
Azure API Management (APIM) è un servizio di Microsoft Azure che consente di pubblicare, proteggere, monitorare e gestire le API in modo sicuro e scalabile. Il suo obiettivo principale è facilitare l'esposizione delle API a consumatori esterni o interni, gestendo...
Leggi l'articoloData Fabric: la chiave per la gestione dei dati...
21.08.2024
Nel panorama digitale odierno, le aziende si trovano ad affrontare una quantità di dati senza precedenti, provenienti da fonti disparate e distribuiti su piattaforme diverse, sia on-premises che nel cloud. La sfida non è solo raccogliere questi dati, ma anche...
Leggi l'articoloEvent Driven Architecture vs RESTful Architecture
15.07.2024
Nel panorama sempre in evoluzione dello sviluppo software, la scelta dell'architettura giusta è cruciale per il successo di qualsiasi progetto. Due dei paradigmi architetturali più utilizzati oggi sono l'Event-Driven Architecture (EDA) e la RESTful Architecture. Entrambi offrono approcci distinti per...
Leggi l'articoloI vantaggi della system integration per le Online...
25.06.2024
Le Online Travel Agency (OTA) svolgono un ruolo cruciale nel settore dei viaggi, offrendo una piattaforma centralizzata per prenotare voli, hotel, noleggi auto e altri servizi turistici. Nel 2023, le prenotazioni globali tramite OTA sono cresciute del...
Leggi l'articoloOmnicanalità: strategie in ambito Retail
4.06.2024
L'omnicanalità nel settore retail è una strategia che integra diversi canali di vendita e comunicazione per offrire un'esperienza cliente fluida e coerente, indipendentemente dal punto di contatto utilizzato. Questa strategia va oltre il semplice uso di più canali (multicanalità) perché mira a creare un'integrazione completa e...
Leggi l'articoloIntelligenza artificiale e mercato eCommerce...
23.01.2024
L'intelligenza artificiale (IA) ha un impatto significativo nel settore dell'e-commerce, contribuendo a migliorare l'esperienza degli utenti, ottimizzare le operazioni e aumentare le vendite. L’AI è senza dubbio il trend tecnologico del momento e le sue applicazioni sono molteplici...
Leggi l'articoloAPI led connectivity: cos’è e perché...
16.11.2023
La connotazione e il ruolo delle API è drasticamente cambiato nell’era della Digital Transformation: le API sono ora il nuovo modello di business, non sono più utilizzate esclusivamente all’interno di un’organizzazione, ma sono esposte ad utenti esterni in tutto il mondo. Per questo è necessario parlare di API-led connectivity, ossia un...
Leggi l'articoloChe cos’è l’API governance?
5.09.2023
Le API sono di gran lunga la modalità di integrazione e di comunicazione più usata tra applicativi differenti, in particolare le API REST. Il successo del modello deriva primariamente da fattori come la semplicità dell'implementazione...
Leggi l'articoloTangle: il futuro delle blockchain
24.07.2023
La tecnologia blockchain si sta espandendo a macchia d’olio: sono sempre più le aziende che investono in formazione su questa tecnologia, sia per interesse interno, che per soddisfare le richieste da parte dei clienti. Gli stessi clienti stanno cercando di capire se la tecnologia blockchain possa essere di loro interesse e utile al loro business. Nell'ambito...
Leggi l'articoloGli strumenti di monitoraggio e observability
17.07.2023
Per rendere efficiente la gestione degli applicativi è necessario utilizzare strumenti di monitoraggio e di observability. Questa è una best practice che permette di tenere sotto controllo gli eventi e implementare un sistema di alerting personalizzato, in modo da...
Leggi l'articoloI benefici della standardizzazione delle API e...
6.06.2023
Nell'era digitale odierna, in cui le aziende si affidano sempre più ai servizi web e a un’architettura distribuita per svolgere i loro compiti, la standardizzazione delle API e l'adozione di un pattern coerente diventano fattori critici per il successo dell’organizzazione. In primis, la standardizzazione delle API e dei microservizi consente...
Leggi l'articoloLa digitalizzazione nel settore energetico: dalla...
12.05.2023
Nel settore energy e utilities, la digitalizzazione ha un impatto lungo l'intera catena del valore, dalla produzione al consumo, passando per la distribuzione e la manutenzione delle reti...
Leggi l'articoloRetail Omnichannel: significati e tecnologie da...
3.04.2023
Negli ultimi anni, si parla sempre più spesso del concetto di Retail Omnichannel: l’omnicanalità è infatti una delle strategie digitali principali dei Retailer, italiani ed internazionali. Questo concetto è stato poi implementato...
Leggi l'articoloSicuro by design: lo sviluppo software con...
29.03.2023
A fronte della crescita dell’attenzione rispetto agli aspetti legati alla sicurezza informatica, all’approccio DevOps si affianca sempre più spesso il concetto di DevSecOps per evidenziare la necessità di assicurare l’automazione della security sin dalla fase di progettazione del software...
Leggi l'articoloTrend ICT 2023: le tecnologie da non perdere
19.01.2023
L’investimento in digitale è in continua crescita: nonostante la crisi, rispetto al 2022, per il 2023 è previsto un incremento del 3% in investimenti ICT, per un totale di circa 79 miliardi di euro. Le previsioni...
Leggi l'articoloCobol software modernization: aggiornare gli...
12.12.2022
Quando si parla di linguaggi datati come il Cobol, non si può non parlare di Cobol software modernization, ossia il processo di rifacimento e ammodernamento dei software legacy scritti...
Leggi l'articoloLegacy modernization: approcci e strategie
10.11.2022
La legacy modernization è il processo di aggiornamento, ammodernamento e innovazione degli applicativi più datati ancora in uso. I sistemi legacy sono software obsoleti...
Leggi l'articoloiPaaS: l’integrazione di applicativi...
4.11.2022
Le soluzioni iPaaS sono integration platform che permettono di creare e gestire i flussi di integrazione da un’unica dashboard, collegando gli applicativi direttamente in cloud...
Leggi l'articoloDeployment automation: update veloci ed affidabili
28.10.2022
La deployment automation permette di trasferire il software dall’ambiente di test a quello di produzione -e viceversa- tramite processi automatizzati: si ottengono così deploy ripetibili e affidabili per l’intero ciclo di distribuzione dell’applicativo. Questa funzionalità...
Leggi l'articoloSoftware integration: connetti i tuoi...
14.10.2022
Che cosa si intende per software integration? Si tratta dell’integrazione di più applicativi, normalmente tramite un middleware di integrazione, come un Enterprise Service Bus. Stiamo parlando quindi...
Leggi l'articoloIntegration middleware: connessioni sicure e...
10.10.2022
Un integration middleware non è un altro che un layer posto tra due sistemi per facilitarne la comunicazione, permettendo una connessione diretta e senza interruzioni. Il ruolo del middleware è fondamentale data...
Leggi l'articoloSviluppo software personalizzato: perché...
6.10.2022
Sono diverse le ragioni per le quali optare per lo sviluppo software personalizzato può rappresentare un investimento chiave in termini di dinamicità e di efficienza dei sistemi informativi di un’azienda. Lo sviluppo di un software su misura fornisce...
Leggi l'articoloTool DevOps per la gestione delle pipeline
6.10.2022
Scegliere i giusti tool DevOps è senza dubbio un aspetto fondamentale per poter gestire le pipeline CI/CD in linea con le aspettative. La scelta deve tenere conto non solo delle funzionalità necessarie oggi, ma...
Leggi l'articoloIl ruolo del System Integrator...
6.10.2022
Se fino a qualche anno fa, con questo termine si poteva far riferimento a connessioni punto-punto tra due o più applicativi diversi, negli ultimi anni la tendenza è quella della horizontal integration dove il layer comune è rappresentato da un Enterprise Service Bus...
Leggi l'articoloMicroservizi e container: parola d’ordine...
5.10.2022
L’accoppiata tecnologica microservizi e container è la soluzione architetturale più moderna per lo sviluppo e la modernizzazione degli applicativi informatici. Questo binomio supera l’implementazione oramai obsoleta...
Leggi l'articoloAPI Management: gestire le API da un’unica...
27.09.2022
Se le Api rappresentano un elemento indispensabile per velocizzare la delivery, è anche vero che più il numero di Api cresce, più la sua gestione può diventare complicata ed è quindi necessaria una piattaforma per la gestione e il monitoraggio...
Leggi l'articoloContainer platform: orchestrazione con Kubernetes...
12.08.2022
Sono circa il 30% le aziende che già utilizzano una container platform all’interno della loro strategia IT: nel report “Market Guide for Cloud Workload Protection Platforms” del 2021, Gartner prevede...
Leggi l'articoloDebito tecnico software: i tool per individuarlo
2.08.2022
Il debito tecnico è un male? Partiamo innanzitutto con il definirlo: si tratta di codice esistente che richiederà più ore di lavoro per essere corretto e sistemato. Questo non significa necessariamente che quella parte sia bad code,...
Leggi l'articoloRPA Software: il nuovo prodotto di Mulesoft
1.08.2022
Secondo le stime di Gartner, entro la fine del 2022, circa l’85% delle grandi aziende avrà implementato una qualche soluzione di RPA software...
Leggi l'articoloArchitetture software distribuite: i vantaggi dei...
1.08.2022
La scelta dell’architettura applicativa giusta è importante perché è il primo step su cui si baserà l’intero processo di sviluppo ed è quindi parte della fase di pianificazione strategica, ...
Leggi l'articoloPipeline DevOps CI/CD: vantaggi tecnici e di...
22.07.2022
Development + Operations= da questa unione nasce il termine e il concetto di pipeline DevOps, il paradigma di sviluppo software che coinvolge le aziende sotto l’aspetto culturale, metodologico e tecnologico...
Leggi l'articoloRefactoring: come e quando ristrutturare il codice
15.07.2022
Quando si parla di refactoring, si intende la ristrutturazione del codice volta a renderlo più pulito e facile da manutenere. Con questa attività, è possibile preparare la struttura allo sviluppo di...
Leggi l'articoloDebito tecnico: definizione e soluzioni
12.07.2022
Il termine debito tecnico in informatica si riferisce alle conseguenze di azioni di sviluppo software che intenzionalmente o meno prioritizzano il valore del cliente e/o gli obblighi di progetto...
Leggi l'articoloMulesoft Flex Gateway: novità dell’API...
28.06.2022
Anypoint Flex Gateway è l’ultima novità in casa Mulesoft: è un sistema disegnato per controllare e mettere in sicurezza le API sviluppate con...
Leggi l'articoloAPI Management Platform: sicurezza per lo scambio...
13.06.2022
Un'API Management platform è la soluzione centralizzata che permette alle aziende e ai team IT di creare, gestire e monitorare le Application Programming Interface. Le APIs sono...
Leggi l'articoloSupply chain evoluta per distribuzione con la...
9.06.2022
Negli ultimi anni, il sistema della distribuzione è stato interessato da un’ulteriore sofisticazione delle esigenze. Il mercato e la sempre maggiore interazione con partner esterni all’azienda...
Leggi l'articoloSystem Integration e stabilità: a che punto è...
3.06.2022
L’ecosistema informativo di un’azienda può risultare molto articolato e come tale essere composto da software diversi che necessitano di comunicare tra loro...
Leggi l'articoloRfid logistica: il controllo dello stato di...
20.05.2022
Il problema dell’erronea conservazione della merce durante il trasporto impatta pesantemente le aziende del settore logistico- trasporti: circa il 66% di tutti reclami sono infatti imputabili alle aziende che manipolano la merce...
Leggi l'articoloTalend Data Fabric: piattaforma per la system...
10.05.2022
Talend è il software di integrazione dei dati, applicativi ed API che permette di gestire, da un’unica piattaforma, l’intero ciclo di vita dei dati e la loro governance...
Leggi l'articoloApi management platform. Lavorare meglio...
2.05.2022
Progettare l’integrazione di sistemi IT aziendali significa valorizzare il riutilizzo degli asset aziendali già esistenti, e al contempo rendere fluida la creazione e il consumo...
Leggi l'articoloIntegrazione di sistemi via API: ruolo...
15.04.2022
L'integrazione di sistemi con l’Enterprise Service Bus, in ottica di migliore gestione dei processi aziendali. Che ruolo ha questo strumento e come funziona?...
Leggi l'articoloApplication Security Testing e gli strumenti di...
7.04.2022
L’Application Security Testing (AST) è processo di identificazione e valutazione delle vulnerabilità del codice sorgente di un'applicazione, finalizzato...
Leggi l'articoloCome funziona un IT assessment e perché...
7.04.2022
L’IT assessment è l’analisi del contesto applicativo e dei relativi processi informatici di una specifica azienda...
Leggi l'articoloVulnerabilità informatica e sicurezza delle...
7.04.2022
Il rischio di esporre informazioni aziendali confidenziali o dati personali sensibili degli utenti ha spinto molte aziende a investire nella sicurezza dei propri applicativi web...
Leggi l'articoloSviluppo Software personalizzato: ultime news e...
18.03.2022
Quando di parla di software personalizzato, e in generale di sviluppo software, è importante monitorare sempre quel che avviene nel mondo del development e individuare tempestivamente le novità tecnologiche più interessanti...
Leggi l'articoloSOA Architecture ed Enterprise Service Bus
24.02.2022
La SOA Architecture è un’architettura software basata sul principio del riutilizzo dei componenti grazie all’uso di servizi web, risultando quindi un’architettura distribuita di componenti isolati che...
Leggi l'articoloRPA Robotic Process Automation: significato e...
21.02.2022
RPA Robotic Process Automation- è una tecnologia che impiega strumenti software per eseguire delle sequenze predeterminate di attività interagendo direttamente con fonti documentali o con le interfacce di altri applicativi...
Leggi l'articoloApplication Modernization: prospettive e benefici
14.02.2022
L’application modernization si conferma uno dei trend informatici di questi ultimi anni, ma sono ancora molte le aziende che si avvalgono di un software legacy per i loro processi di core business...
Leggi l'articoloIl Process mining come strumento di Business...
14.02.2022
Un approccio alternativo per il monitoraggio dei processi di business viene offerto dalle tecniche di process mining che...
Leggi l'articoloMulesoft si conferma Leader del Magic Quadrant di...
11.02.2022
Per il sesto anno consecutivo, Mulesoft si conferma Leader nei Magic Quadrant di Gartner per le soluzioni di Full Lifecycle API Management e di Enterprise iPaaS...
Leggi l'articoloLegacy software modernization: come innovare gli...
11.02.2022
La legacy software modernization è un’esigenza sempre più sentita dalle aziende, in particolare per le imprese che vorrebbero investire in innovazione tecnologica, ma che possiedono sistemi informativi non al passo con i tempi...
Leggi l'articoloLa Digital Transformation nel settore Retail: i...
10.02.2022
Ad oggi, non si può che parlare di Digital Retail e questo interessa in particolare tre aree: le operazioni di back-end, la customer experience e l’omnicanalità...
Leggi l'articoloLa containerizzazione delle applicazioni: come e...
10.02.2022
La containerizzazione permette di raggruppare tutti i componenti e le dipendenze di un’applicazione in un singolo contenitore isolato, detto “container”...
Leggi l'articoloMigrazione cloud: quando e come progettarla
27.08.2021
La migrazione verso il cloud è uno dei top trend del settore ICT e definito spesso “il motore per eccellenza della digitalizzazione delle aziende”...
Leggi l'articoloContributo digitalizzazione delle imprese e PA...
9.07.2021
La Commissione Europea ha approvato il Piano nazionale di ripresa e resilienza presentato dal Governo italiano che prevede un forte contributo digitalizzazione...
Leggi l'articoloApi Manager di Mulesoft: metti in sicurezza le...
1.07.2021
Api Manager di Mulesoft è un componente di Anypoint Platform che fornisce un unico web based control panel per gestire in sicurezza le tue Api e i microservizi, a prescindere da dove sono deployati...
Leggi l'articoloLe strategie di software modernization per gli...
18.05.2021
Breaking news: potrebbe non servirti un nuovo applicativo, ma solo un processo di software modernization...
Leggi l'articoloMulesoft Monitoring: ottieni visibilità sul tuo...
6.05.2021
Mulesoft monitoring è il tool di Anypoint Platform che si occupa di fornire visibilità alle integrazioni implementate all’interno dell’application network e fornisce preziosi feedback dai flussi di Mule e dagli altri componenti...
Leggi l'articoloTrend IT: ambiti e iniziative per la...
19.04.2021
Una panoramica sui trend IT del 2020 e 2021 e le previsioni per i prossimi anni. Su quali paradigmi e tecnologie investiranno le aziende nel 2021? Cosa cambierà con l’arrivo del pacchetto di aiuti Next Generation EU?...
Leggi l'articoloSensoristica e Internet of things: il ruolo...
29.03.2021
L’utilizzo di sensori per la misurazione di determinati parametri è spesso abbinato all’utilizzo di oggetti intelligenti, quei componenti che rientrano nella definizione di Internet of things...
Leggi l'articoloSoftware gestione documentale: i top player del...
22.03.2021
Il software per la gestione documentale è un applicativo in uso oramai da alcuni anni ma, grazie a nuove tecnologie, si è arricchito di funzionalità...
Leggi l'articoloAlfresco Community vs Enterprise: quale versione...
26.02.2021
Alfresco community è la versione gratuita del software leader del mercato delle piattaforme di content management. Alfresco è un software open source e prevede due diverse versioni: la community e l’enterprise...
Leggi l'articoloPerché il Service Mesh è la soluzione ideale...
19.02.2021
Il mesh di Mulesoft è una soluzione che permette di scoprire, gestire e mettere in sicurezza qualsiasi servizio eseguito verso Kubernets, a prescindere dal linguaggio di programmazione utilizzato per scriverlo...
Leggi l'articoloEnterprise content management: gestione smart dei...
27.01.2021
L’Enterprise content management è il servizio informatico di gestione documentale per le aziende e comprende diversi strumenti...
Leggi l'articoloPerché investire nell’architettura a...
25.01.2021
L'architettura a microservizi è stata inserita da Mulesoft all’interno del recentissimo report “Top 8 trends shaping digital transformation in 2021” e, proprio per questo...
Leggi l'articoloPlsql e il database Oracle: caratteristiche e...
14.01.2021
Plsql è il linguaggio di programmazione di proprietà di Oracle che permette ai developer di interfacciarsi con il database...
Leggi l'articolol ruolo dei system integrator italiani nel...
13.01.2021
Stiamo parlando della figura che si occupa dell’integrazione software, ossia di mettere in comunicazione applicativi diversi, assicurando lo scambio puntuale di dati e informazioni...
Leggi l'articoloAlfresco software è Leader del Magic Quadrant
13.01.2021
Alfresco Software per la prima volta scala il Magic Quadrant di Gartner, diventando “Leader” del mercato delle Content Services Platform...
Leggi l'articoloGestione documentale: software free, open source...
2.12.2020
La gestione documentale accelera i processi di gestione dei documenti da parte dei dipendenti e permette loro di risparmiare tempo e portare a termine il proprio task in minor tempo...
Leggi l'articoloSoftware logistica: efficienza dal magazzino al...
9.11.2020
Tra le trasformazioni che negli anni hanno interessato la logistica, la digitalizzazione è senz’altro quella più rilevante e l’utilizzo di un applicativo ad hoc è diventato un imperativo nel settore...
Leggi l'articoloApplication Programming interface e Connectivity...
19.10.2020
Le Application Programming Interface (Api) sono parte integrante del processo di sviluppo di nuovi progetti e sono state utilizzate per nuovi processi di integrazione dal 52% delle aziende intervistate per il “Connectivity benchmark report”...
Leggi l'articoloProgrammazione Cobol: il linguaggio del passato...
8.10.2020
Nonostante abbia compiuto da poco 50 anni, la programmazione Cobol è ancora al centro di diversi settori di business, in particolare quello bancario e governativo...
Leggi l'articoloAlfresco Content Services: la gestione...
8.10.2020
Alfresco Content Services è il servizio di Enterprise content management completo e perfetto per le aziende che cercano velocità, scalabilità e un servizio di assistenza che non ti lascia mai solo...
Leggi l'articoloMulesoft connector: scegli e crea i tuoi...
30.09.2020
I Mulesoft connector di Anypoint sono estensioni riutilizzabili al Mule runtime engine. La loro funzione è quella di integrare un’applicazione Mule con elementi terzi di diverso tipo...
Leggi l'articoloSoftware Retail e soluzioni informatiche di...
22.09.2020
Tutti i top player utilizzano un software retail, ossia un applicativo in grado di gestire tutte gli step della catena di fornitura legato al commercio di prodotti di ogni tipo. L’utilizzo di uno o più applicativi permette di razionalizzare e ottimizzare la gestione della Supply Chain, dal fornitore sino al consumatore...
Leggi l'articoloLo sviluppo software personalizzato per gestire i...
8.09.2020
La caratteristica principale di un software personalizzato è la flessibilità: la customizzazione permette alle aziende di richiedere un prodotto sviluppato interamente sulle proprie esigenze e quindi ideale per garantire la massima efficienza dei propri processi business...
Leggi l'articoloSoftware gestione magazzino: a cosa serve e...
1.09.2020
Per accelerare le operazioni di magazzino e assicurarne l’efficienza, è importante scegliere il software gestione magazzino adatto alla propria attività...
Leggi l'articoloAngular 10: novità e vantaggi
27.07.2020
Oggi Angular significa flessibilità per lo sviluppatore, innovazione e qualità per il cliente. Il framework è modulare e altamente scalabile...
Leggi l'articoloIl Content management per superare la crisi
16.06.2020
Con l’emergenza sanitaria causata dalla pandemia da COVID-19, il digitale ha preso il sopravvento e ha messo in difficoltà tante aziende per le quali i registri cartacei erano ancora lo strumento principale. In pochi giorni, tantissime aziende e dipendenti si sono trovati a dover...
Leggi l'articoloSystem Integration e Api management per i servizi...
11.06.2020
Nel caso di aziende che forniscono web service, l’approccio api-led e l’integrazione sono fondamentali: la tecnologia informatica è in continua evoluzione e con i continui aggiornamenti, la novità di un determinato prodotto ha vita breve. Per non parlare dei prodotti storici che devono coesistere con gli ultimi tool...
Leggi l'articoloSoftware personalizzato: una panoramica delle...
5.05.2020
Richiedere lo sviluppo di un software su misura significa progettare assieme ai fornitori un applicativo pensato specificatamente sulle esigenze della propria azienda e delle proprie attività. Questo tipo di offerta si differenzia da quella basata su software a pacchetto...
Leggi l'articoloSpesa online: l’integrazione della...
28.04.2020
Grazie all’utilizzo di un layer di integrazione Enterprise Service Bus, è possibile infatti mettere in diretta comunicazione il software in uso sulla piattaforma di spesa online con gli altri applicativi informatici utilizzati in azienda e dai fornitori e clienti...
Leggi l'articoloIntegrazione della Supply Chain e ottimizzazione...
8.04.2020
L’Api-led connectivity è una strategia per connettere in maniera efficace i dati agli applicativi, utilizzando 3 livelli di Application Programming Interface, ognuno con specifici obiettivi, che creano asset aziendali riutilizzabili e declinabili per specifiche experience...
Leggi l'articoloDigitalizzazione delle imprese italiane: numeri e...
24.03.2020
Per affrontare l’emergenza Corona virus, il Ministero per l’innovazione tecnologica e la digitalizzazione, ha reso disponibile la pagina web “Solidarietà digitale” dove imprese e startup possono mettere a disposizione...
Leggi l'articoloL’Integrazione dei sistemi informativi nel...
18.03.2020
Nel settore Retail, l’integrazione dei sistemi informativi apporta numerosi vantaggi, in particolare al ciclo delle merci e ai processi logistici. Ogni Retailer si avvale di differenti applicativi per gestire tutta la supply chain, dalla fornitura alla distribuzione...
Leggi l'articoloLogistica di magazzino nella GDO: far fronte a un...
10.03.2020
Dal 24 febbraio al primo di marzo, le vendite sono aumentate in media del 12,21%, con picchi nel Settentrione e successivi aumenti anche nel Centro e Sud Italia...
Leggi l'articoloLa fatturazione elettronica a PA e privati...
3.03.2020
L’obbligatorietà della trasmissione elettronica della fattura tra soggetti privati è stata introdotta dal 1° gennaio 2019, cinque anni più tardi rispetto all’obbligatorietà imposta per la fatturazione verso le pubbliche amministrazioni...
Leggi l'articoloGli strumenti informatici al servizio dello smart...
28.02.2020
Nel 2019 in Italia erano presenti solo 570 mila smart worker contro, ad esempio, i 5 milioni e quattrocento mila del Regno Unito. Questo banalissimo dato porta a riflettere sulla necessità di un profondo cambiamento culturale all’interno delle aziende italiane che porterebbe...
Leggi l'articoloOmnia compie 25 anni: un faccia a faccia con...
19.02.2020
Salvatore Persiano è uno dei fondatori di Omnia Group e attuale Presidente del gruppo. Con una solida formazione informatica e dopo anni di lavoro presso aziende IT del territorio fiorentino, Salvatore Persiano coglie quella che viene vista come un’opportunità per fare della propria passione per l’informatica un’azienda vera e propria...
Leggi l'articoloAlfresco gestione documentale: le novità del...
20.01.2020
A partire dal 2019, il software Alfresco gestione documentale, ha rilasciato alcuni aggiornamenti dei suoi componenti, nell’ottica di agevolare la ricerca dei documenti e introducendo modelli di Machine Learning e di Intelligenza Artificiale...
Leggi l'articoloMulesoft Anypoint è leader del mercato iPaaS e...
19.12.2019
Sono diciassette le aziende inserite da Gartner nel suo Magic Quadrant 2019 per il settore Integration Platform e Mulesoft Anypoint Platform si conferma una di queste...
Leggi l'articoloDigital Retail: significato e applicazioni
16.12.2019
I cambiamenti in atto nel mondo del commercio al dettaglio sono oramai evidenti da alcuni anni, in particolare l’avvento del Digital Retail. Innanzitutto, il ruolo del negozio sta cambiando: con l’avvento del commercio online e delle piattaforme di e-commerce, il negozio fisico...
Leggi l'articoloAlfresco si conferma azienda...
4.12.2019
Nel report del 2019, Alfresco si conferma all’interno della breve lista di aziende protagoniste nel settore delle soluzioni di Content Service Platform. Nel quadrante viene inserito tra i “Challenger”: la sua forza è...
Leggi l'articoloCos’è Docker e perché rende il business più...
29.11.2019
Docker utilizza un approccio del tutto diverso: se con una macchina virtuale lo sviluppatore immette il codice negli ambienti dove sarà eseguito, con i container invece si costruisce l’intero ambiente e poi lo si distribuisce ovunque...
Leggi l'articoloMulesoft e la Digital Transformation nel 2020
27.11.2019
Digital transformation: i trend per il 2020 secondo Mulesoft Mulesoft, società di software americana di proprietà di Salesforce, i cui prodotti sono potentissimi alleati di migliaia di aziende in tutto il mondo, ha pubblicato recentemente un report sulle tendenze di digital transformation per il 2020...
Leggi l'articoloI risultati di Mulesoft e la novità di Mulesoft...
28.10.2019
La struttura a microservizi presenta però anche alcune difficoltà, legate in particolare alla frammentazione che la caratterizza. Per coordinare le informazioni dei diversi microservizi, Mulesoft ha annunciato l’uscita di una nuova soluzione: Anypoint Service Mesh...
Leggi l'articoloMicroservizi, Docker e DevOps: i pilastri...
25.10.2019
Alle imprese che aumentano gli investimenti in digitalizzazione, per diminuire il time-to-market dei loro progetti e rendere i processi interni più snelli e flessibili, l’IT fornisce soluzioni sempre più competitive e avanzate...
Leggi l'articoloI fondi europei per la Digital Transformation
10.10.2019
Il tema della digital transformation delle imprese è uno dei maggiori obiettivi portati avanti dall’Unione Europea e per il quale, negli anni, sono stati stanziate diverse tipologie di fondi e di agevolazioni...
Leggi l'articoloLe ultime tendenze tecnologiche del settore Retail
10.09.2019
Il settore del Retail è quello che più deve approfittare dello sviluppo di nuove tecnologie legate all’esperienza di acquisto dei consumatori. Al fine di instaurare una migliore relazione con la clientela, è necessario puntare sulla Digital Transformation come vera leva per rendere il proprio sistema il più integrato possibile...
Leggi l'articoloLa crescita della Gestione Documentale e i motivi...
30.07.2019
La ragione di fondo della crescita del sistema documentale è senza dubbio l’ampio spazio occupato dai fogli cartacei e l’alto rischio di deperibilità degli stessi. La gestione dei documenti attraverso software specifici è quindi la soluzione perfetta per entrambe le problematiche...
Leggi l'articoloInternet of Things e soluzioni smart per le...
12.07.2019
L’Internet delle cose non è altro che la connessione di oggetti alla rete: grazie a questo collegamento, il dispositivo acquista intelligenza e cessa di essere un semplice oggetto per diventare piuttosto uno strumento in grado di fornire dati e informazioni, nonché di accedere ai dati distribuiti dagli altri oggetti connessi alla rete...
Leggi l'articoloSoluzioni di Digital Transformation per la Supply...
3.07.2019
Di fronte a una domanda di beni e servizi sempre più mutevole e instabile, le aziende hanno la necessità di migliorare competitività ed efficienza dei processi logistici e soprattutto di renderli più flessibili, per dare una...
Leggi l'articoloChe cos’è la System Integration e a cosa...
24.06.2019
Perché la System Integration può rappresentare una valida soluzione per ridurre i costi e massimizzare le potenzialità del business? Parliamoci chiaro: le infrastrutture informatiche delle aziende diventano sempre più complesse. E mentre aumentano i software e gli endpoint, le imprese devono...
Leggi l'articoloReact o Angular? Quali sono i trend del 2019?
10.06.2019
Qual è il miglior framework JavaScript: React o Angular? Proviamo a valutarne caratteristiche e differenze, per scegliere quello più adatto al nostro progetto...
Leggi l'articoloMake or Buy? Come scegliere tra software custom e...
3.05.2019
Per un’azienda è più conveniente sviluppare un software custom oppure acquistare un pacchetto standard off the shelf? Qualche spunto di riflessione per chi è chiamato a prendere questa decisione...
Leggi l'articoloCome cambia l’IT nell’era del cliente...
11.04.2019
Il Mulesoft annual Connectivity benchmark report si propone di individuare i principali trend tecnologici, gli obiettivi delle imprese e le difficoltà che incontrano nel perseguirli...
Leggi l'articoloI vantaggi dei software open source per le aziende
11.04.2019
Quali sono i vantaggi derivanti dall’adozione di software open source per le imprese? Gli strumenti open source sono adatti ad un contesto enterprise?...
Leggi l'articoloBig Data Analysis e Retail – 7 casi d’uso
25.03.2019
Come sta cambiando la vendita al dettaglio nell’era della big data analysis e come i retailer possono usare i big data a vantaggio proprio e dei propri clienti?...
Leggi l'articoloAlfresco: novità e tendenze per il 2019
14.02.2019
Abbiamo seguito con interesse il Webinar di Alfresco “Trends and Transformation”, in cui i relatori hanno raccontato cosa ci si aspetta da Alfresco nel 2019. Ecco quali saranno le novità e tendenze di quest’anno...
Leggi l'articolo7 Vantaggi dei microservizi
31.01.2019
Lo sviluppo di applicazioni con un approccio a microservizi è sul punto di diventare uno dei trend principali del settore IT: secondo un sondaggio di Nginx, il 36% delle imprese intervistate li sta già utilizzando, mentre il 26% sta analizzando le modalità per farlo...
Leggi l'articoloIT: 7 investimenti chiave per il 2019
4.01.2019
Il sondaggio di Gartner, “2019 CIO Agenda: Secure the Foundation for Digital Business“, identifica le aree della Digital Transformation che stanno ricevendo i maggiori investimenti, nonché i settori che invece sono in fase di ridimensionamento...
Leggi l'articolo2019: Investimenti IT in aumento
18.12.2018
2019: Investimenti IT in aumento! Nel 2019 gli investimenti delle aziende in tecnologie informatiche cresceranno e si focalizzeranno sull’infrastruttura, la sicurezza e la user experience...
Leggi l'articoloDocker lancia Docker Desktop Enterprise: ecco...
4.12.2018
Alla conferenza DockerCon Europe 2018, Docker ha lanciato Docker Desktop Enterprise, un’istanza dello strumento utilizzato per la creazione di applicazioni containerizzate che consente agli sviluppatori di lavorare con un’interfaccia utente grafica (GUI) invece che con le righe di comando...
Leggi l'articolo5 motivi per cui la Big Data Analysis offre un...
21.11.2018
Soltanto il 7% delle PMI nel 2018 ha avviato progetti di Big Data Analytics, mentre quattro su dieci dichiarano di svolgere analisi tradizionali sui dati aziendali...
Leggi l'articoloeQuality4Logistics: metti al sicuro le tue...
8.11.2018
Il progetto eQuality4Logistics, di cui Omnia è partner, intende realizzare un servizio innovativo che consenta il controllo sulla merce trasportata ed incrementi la qualità della logistica dei trasporti di merci deperibili, fragili e di valore...
Leggi l'articoloAlfresco nel Magic Quadrant di Gartner 2018...
4.11.2018
Il software per la gestione documentale Alfresco si posiziona nel “Gartner Magic Quadrant” 2018 per le Piattaforme di Servizi di Contenuto...
Leggi l'articoloMuleSoft lancia la nuova versione di Anypoint...
31.10.2018
Grazie all’apprendimento automatico, informazioni in real-time e sicurezza avanzata, ora integrati nella Anypoint Platform di MuleSoft, le aziende ottengono una visibilità senza precedenti sulle loro reti applicative, accelerando così...
Leggi l'articolo